|
Спектры излучения и поглощения в атомах водорода
|
|
|
|
Спектры излучения и поглощения в атомах водорода
|
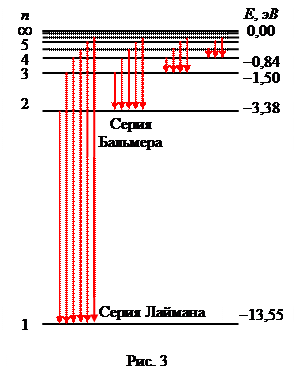
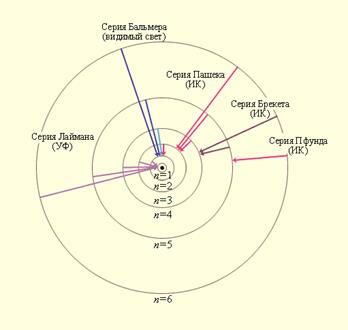
Простейшим из атомов является водород. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно ( И. Бальмер, Швейцария, 1885 г. ). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
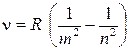 , т =1, 2, 3, 4, 5, 6; n = m +1, m +2, … (1)
, т =1, 2, 3, 4, 5, 6; n = m +1, m +2, … (1)
где R = 3, 29× 1015 с-1 – постоянная Ридберга. Для серии Бальмера в видимом свете m = 2, n = 3, 4, 5, ... . Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4, ... . До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода оставались непонятными.
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
46. Постулаты Бора. Квантование орбит. Боровская теория атома водорода
1. Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные состояния, в которых он не излучает энергию. Этим состояниям соответствуют стационарные орбиты электронов. Движение электронов по стационарным орбитам не сопровождается излучением.
|
|
|
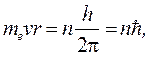
 (1)
(1)
|
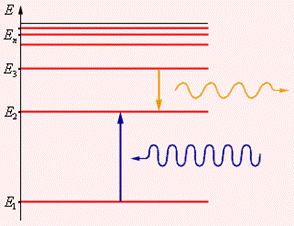
2. Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией, равной разности энергий соответствующих стационарных состояний до и после излучения
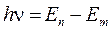 , (2)
, (2)
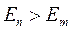 - излучение;
- излучение; 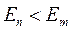 - поглощение;
- поглощение;
Набор 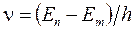 составляет линейчатый спектр атома, n - главное квантовое число.
составляет линейчатый спектр атома, n - главное квантовое число.
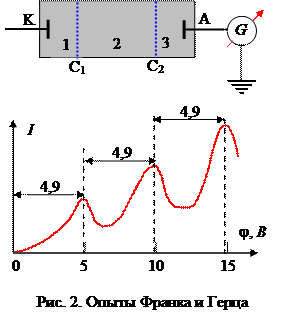
Опыты Д. Франка и Г. Герца (1913 г. )
|
Получено прямое экспериментальное доказательство существования стационарных состояний атома и квантования энергии.
Метод задерживающего потенциала, вакуумная трубка с парами ртути (Р = 13 Па); С1, С2 - ускоряющая и задерживающая сетки.
Подтверждение 1-го постулата:
электроны передают энергию порциями с наименьшим квантом 4, 9 эВ.
Подтверждение 2-го постулата:
атомы ртути, получив энергию DЕ, должны излучать квант с частотой

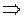
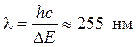
- источник ультрафиолетового излучения.
Спектр атома водорода по Бору
Постулаты Бора позволили рассчитать спектр атома водорода состоящего из ядра с зарядом Ze и одного электрона
 (6)
(6)
|
|
Для атома водорода (Z = 1) радиус первой орбиты электрона (n = 1), первый Боровский радиус
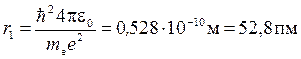 .
.
Полная энергия электрона в водородоподобной системе принимает дискретные значения:
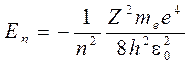 , n =1, 2, 3, … (7)
, n =1, 2, 3, … (7)
n - главные квантовыечисла;
|
|
|
n = 1 - основное (нормальное ) состояние;
n > 1 - возбужденные состояния.
Е(n=¥ )=Emax=0 - состояниесоответствуетионизации атома (отрыву от него электрона).
|
|
|